Das Kleinhirn (19459006) (lateinisch für "kleines Gehirn") ist ein Hauptmerkmal des Hinterhirns aller Wirbeltiere. Obwohl in der Regel kleiner als das Großhirn, kann es bei manchen Tieren wie den Mormyridenfischen so groß oder sogar noch größer sein. [1] Beim Menschen spielt das Kleinhirn eine wichtige Rolle bei der motorischen Kontrolle. Es kann auch an einigen kognitiven Funktionen wie Aufmerksamkeit und Sprache sowie an der Regulierung von Angst- und Lustreaktionen beteiligt sein [2] aber seine bewegungsbezogenen Funktionen sind die am besten etablierten. Das menschliche Kleinhirn leitet keine Bewegung ein, sondern trägt zur Koordination, Präzision und zum genauen Timing bei: Es empfängt Input von sensorischen Systemen des Rückenmarks und von anderen Teilen des Gehirns und integriert diese Inputs, um die motorische Aktivität fein abzustimmen. [19659005] Zerebellare Schäden führen zu Störungen der Feinbewegung, des Gleichgewichts, der Körperhaltung und des motorischen Lernens beim Menschen. [3]
Das menschliche Kleinhirn sieht anatomisch wie eine separate Struktur aus, die an der Unterseite des Gehirns befestigt ist und unter den Gehirnhälften liegt. Ihre kortikale Oberfläche ist mit fein beabstandeten, parallelen Rillen bedeckt, im Gegensatz zu den breiten unregelmäßigen Windungen der Großhirnrinde. Diese parallelen Rillen verbergen die Tatsache, dass es sich bei der Kleinhirnrinde tatsächlich um eine durchgehende dünne Gewebeschicht handelt, die im Stil eines Akkordeons fest gefaltet ist. In dieser dünnen Schicht befinden sich verschiedene Arten von Neuronen mit einer sehr regelmäßigen Anordnung. Die wichtigsten sind Purkinje-Zellen und Granulazellen. Diese komplexe neuronale Organisation führt zu einer massiven Signalverarbeitungsfähigkeit, aber fast die gesamte Ausgabe der Kleinhirnrinde durchläuft eine Reihe kleiner Kerne, die im Inneren der weißen Substanz des Kleinhirns liegen. [4]
Zusätzlich zu ihrer direkten In der motorischen Kontrolle spielt das Kleinhirn eine wichtige Rolle für verschiedene Arten des motorischen Lernens, vor allem das Lernen, sich an veränderte sensomotorische Beziehungen anzupassen. Es wurden mehrere theoretische Modelle entwickelt, um die Sensomotorik-Kalibrierung im Hinblick auf synaptische Plastizität im Kleinhirn zu erklären. Diese Modelle leiten sich von denen ab, die von David Marr und James Albus formuliert wurden, basierend auf der Beobachtung, dass jede Purkinjezelle aus Kleinhirn zwei dramatisch unterschiedliche Arten von Input erhält: Eine besteht aus Tausenden von schwachen Inputs aus den parallelen Fasern der Granulazellen; der andere ist ein extrem starker Input von einer einzigen Kletterfaser. [5] Das Grundkonzept der Marr-Albus-Theorie besteht darin, dass die Kletterfaser als ein "Lehrsignal" dient, das eine dauerhafte Änderung der Stärke der Parallelität bewirkt Glasfasereingänge. Beobachtungen der langfristigen Depression in parallelen Glasfasereingaben haben zwar Theorien dieser Art unterstützt, ihre Gültigkeit bleibt jedoch umstritten. [6]
Structure [ edit
Auf der Ebene der groben Anatomie Das Kleinhirn besteht aus einer eng gefalteten Cortexschicht mit weißer Substanz darunter und einem flüssigkeitsgefüllten Ventrikel an der Basis. In die weiße Substanz sind vier tiefe Kleinhirnkerne eingebettet. Jeder Teil des Kortex besteht aus demselben kleinen Satz neuronaler Elemente, die in einer stark stereotypisierten Geometrie angeordnet sind. Auf einer mittleren Ebene können das Kleinhirn und seine Hilfsstrukturen in mehrere hundert oder tausend unabhängig voneinander funktionierende Module unterteilt werden, die als "Mikrozonen" oder "Mikrokompartimente" bezeichnet werden.
Grobe Anatomie [ edit ]

Das Kleinhirn befindet sich in der hinteren Schädelgrube. Der vierte Ventrikel, Pons und Medulla befinden sich vor dem Kleinhirn. [7] Es ist durch eine Schicht aus ledernem Dura mater, dem Tentorium cerebelli, vom darüberliegenden Cerebrum getrennt. Alle seine Verbindungen mit anderen Teilen des Gehirns wandern durch die Pons. Anatomisten klassifizieren das Kleinhirn als Teil des Metencephalons, zu dem auch die Pons gehören; Das Metencephalon ist der obere Teil des Rhombencephalons oder "Hinterhirns". Wie die Großhirnrinde ist das Kleinhirn in zwei Halbkugeln unterteilt; Es enthält auch eine schmale Mittellinie (Vermis). Ein Satz großer Falten wird nach der Konvention verwendet, um die Gesamtstruktur in 10 kleinere "Läppchen" zu unterteilen. Aufgrund seiner großen Anzahl an winzigen Granula-Zellen enthält das Kleinhirn mehr Neuronen als die Gesamtmenge des restlichen Gehirns, nimmt aber nur 10% des gesamten Gehirnvolumens ein. [8] Die Anzahl der Neuronen im Kleinhirn ist damit verbunden die Anzahl der Neuronen im Neokortex. Es gibt etwa 3,6-mal so viele Neuronen im Kleinhirn wie im Neokortex, ein Verhältnis, das bei vielen verschiedenen Säugetierarten erhalten bleibt. [9]
Die ungewöhnliche Oberflächenerscheinung des Kleinhirns verbirgt die Tatsache, dass der Großteil seines Volumens aus einem Zellkern besteht sehr eng gefaltete Schicht aus grauer Substanz: die Kleinhirnrinde. Jeder Grat oder Gyrus in dieser Schicht wird Folium genannt. Es wird geschätzt, dass sich bei einer vollständigen Entfaltung der menschlichen Kleinhirnrinde eine etwa 1 Meter lange und durchschnittlich 5 cm breite Nervenschicht bilden würde - eine Gesamtfläche von etwa 500 cm 2, die in einem Volumen von Abmessungen gepackt ist 6 cm × 5 cm × 10 cm. [8] Unter der grauen Substanz der Kortikalis befindet sich eine weiße Substanz, die zum größten Teil aus myelinisierten Nervenfasern besteht, die zur und von der Cortex laufen. Eingebettet in die weiße Substanz, die wegen ihres verzweigten, baumartigen Aussehens im Querschnitt manchmal als Lebensbaum (Baum des Lebens) bezeichnet wird, befinden sich vier tiefe Kleinhirnkerne, die aus grauer Substanz bestehen. 19659020] Verbinden des Kleinhirns mit verschiedenen Teilen des Nervensystems sind drei gepaarte Kleinhirnstielen. Hierbei handelt es sich um den oberen Kleinhirnstiel, den mittleren Kleinhirnstiel und den unteren Kleinhirnstiel, benannt nach ihrer Position im Verhältnis zum Vermis. Der obere Kleinhirnstiel ist in erster Linie eine Ausgabe an die Großhirnrinde, wobei die efferenten Fasern über Thalamuskerne zu den oberen Motoneuronen in der Großhirnrinde transportiert werden. Die Fasern entstehen aus den tiefen Kleinhirnkernen. Der mittlere Kleinhirnenstiel ist mit den Pons verbunden und erhält seinen gesamten Input von den Pons hauptsächlich aus den Pontinkernen. Die Eingaben in die Pons stammen aus der Großhirnrinde und werden von den Pontinkernen über transversale Pontinfasern zum Kleinhirn geleitet. Der mittlere Pedunkel ist der größte der drei und seine afferenten Fasern sind in drei getrennten Faszikel gruppiert, die ihre Eingaben in verschiedene Teile des Kleinhirns bringen. Der untere Kleinhirnstiel erhält Input von afferenten Fasern aus den Kernen des Vestibulars, dem Rückenmark und dem Tegmentum. Der Ausgang des unteren Pedunkels erfolgt über efferente Fasern zu den vestibulären Kernen und zur retikulären Formation. Das gesamte Kleinhirn erhält über den unteren Kleinhirnstiel einen modulatorischen Eingang aus dem unteren Olivenkern. [4]
Unterteilungen [


Aufgrund des Oberflächenaussehens können drei Lappen innerhalb des Kleinhirns unterschieden werden: der vordere Lappen (über dem Primärspalt), der hintere Lappen (unterhalb der Primärfissur) und der Flocculonodularlappen (unterhalb der hinteren Fissur). Diese Lappen teilen das Kleinhirn von rostral nach kaudal (beim Menschen von oben nach unten). In Bezug auf die Funktion gibt es jedoch eine wichtigere Unterscheidung in der Dimension von medial nach lateral. Unter Auslassung des flocculonodularen Lappens, der verschiedene Verbindungen und Funktionen hat, kann das Kleinhirn funktional in einen medialen Sektor, der Spinocerebellum, und einen größeren lateralen Sektor, der Kleinhirn genannt wird, eingeteilt werden. [10] Ein schmaler Streifen überragenden Gewebes entlang der Mittellinie wird als bezeichnet Kleinhirnwurm. ( Vermis ist lateinisch für "Wurm".) [10]
Die kleinste Region, der flocculonoduläre Lappen, wird oft als Vestibulozerebellum bezeichnet. Es ist der älteste Teil in evolutionärer Hinsicht (Archicerebellum) und nimmt hauptsächlich an Gleichgewicht und räumlicher Orientierung teil; Seine primären Verbindungen bestehen mit den vestibulären Kernen, obwohl sie auch visuelle und andere sensorische Eingaben erhalten. Schäden in dieser Region führen zu Gleichgewichts- und Gangstörungen. [10]
Die mediale Zone des Vorder- und Hinterlappens bildet das Spinocerebellum, auch Paleocerebellum genannt. Dieser Bereich des Kleinhirns dient hauptsächlich der Feinabstimmung von Körper- und Extremitätenbewegungen. Es erhält propriozeptive Eingaben von den Rückensäulen des Rückenmarks (einschließlich des Spinocerebellar-Trakts) und des N. cranial trigeminus sowie des Seh- und Gehörsystems. Es schickt Fasern zu tiefen Kleinhirnkernen, die wiederum sowohl in die Großhirnrinde als auch in den Hirnstamm projizieren und so die Modulation der absteigenden motorischen Systeme ermöglichen. [10]
Die laterale Zone, die bei Menschen der mit Abstand größte Teil ist, bildet die Cerebrocerebellum, auch als Neocerebellum bekannt. Es erhält Eingangssignale ausschließlich aus der Großhirnrinde (insbesondere dem Parietallappen) über die Pontinkerne (die Kortiko-Ponto-Kleinhirnbahnen bilden) und sendet den Ausgang hauptsächlich an den ventrolateralen Thalamus (der wiederum an motorische Bereiche der vormotorischen Kortex und an den Primärmotor angeschlossen ist) Bereich der Großhirnrinde) und des roten Kerns. [10] Es gibt Uneinigkeit darüber, wie man die Funktionen des lateralen Kleinhirns am besten beschreiben kann: Man nimmt an, dass er an der Planung von Bewegungen beteiligt ist, die in Kürze auftreten werden. [11] Auswertung sensorischer Informationen für Handlungen [10] und in einer Reihe von rein kognitiven Funktionen, z. B. Bestimmen des Verbs, das am besten zu einem bestimmten Substantiv passt (wie in "sit" für "chair"). [12][13][14][15]
Microanatomy edit ]
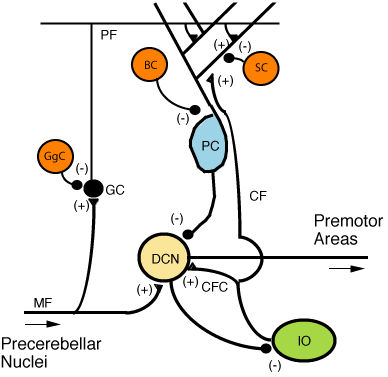
Zwei Arten von Neuronen spielen im Kleinhirnkreis eine dominante Rolle: Purkinje-Zellen und Granula-Zellen. Drei Arten von Axonen spielen ebenfalls eine dominierende Rolle: Moosfasern und Kletterfasern (die von außen in das Kleinhirn gelangen) und parallele Fasern (die Axone von Granulazellen). Durch den Kleinhirnkreislauf gibt es zwei Hauptpfade, die von Moosfasern und Kletterfasern ausgehen, die beide in den tiefen Kleinhirnkernen enden. [8]
Moosfasern dringen direkt in die tiefen Kerne vor, aber auch in den folgenden Weg: Moosfasern → Granulazellen → parallele Fasern → Purkinje-Zellen → tiefe Kerne. Kletterfasern projizieren auf Purkinje-Zellen und senden auch Kollateralen direkt in die tiefen Kerne. [8] Die Eingänge aus moosigen Fasern und Kletterfasern enthalten jeweils faserspezifische Informationen. das Kleinhirn erhält auch dopaminerge, serotonerge, noradrenerge und cholinerge Eingaben, die vermutlich eine globale Modulation bewirken. [16]
Die Kleinhirnrinde ist in drei Schichten unterteilt. An der Unterseite liegt die dicke, mit Granulazellen dichtgefüllte Granulatschicht sowie Interneuronen, hauptsächlich Golgi-Zellen, aber auch Lugaro-Zellen und unipolare Bürstenzellen. In der Mitte liegt die Purkinje-Schicht, eine enge Zone, die die Zellkörper der Purkinje-Zellen und der Bergmann-Gliazellen enthält. An der Spitze liegt die molekulare Schicht, die die abgeflachten dendritischen Bäume der Purkinje-Zellen sowie die riesige Reihe paralleler Fasern enthält, die die Purkinje-Zelle im rechten Winkel durchdringen. Diese äußerste Schicht der Kleinhirnrinde enthält auch zwei Arten von inhibitorischem Interneuron: Sternzellen und Korbzellen. Sowohl Sternzellen- als auch Korbzellen bilden GABAerge Synapsen auf Purkinje-Zellendendriten. [8]

Purkinje-Zellen gehören zu den markantesten Neuronen im Gehirn und einer der frühesten Typen, die erkannt wurden - sie wurden erstmals 1837 vom tschechischen Anatomen Jan Evangelista Purkyně beschrieben. Sie unterscheiden sich durch die Form ihres Dendritenbaums: Der Dendritenzweig sehr üppig, aber in einer Ebene senkrecht zu den Kleinhirnfalten stark abgeflacht. So bilden die Dendriten einer Purkinje-Zelle ein dichtes planares Netz, durch das parallele Fasern im rechten Winkel verlaufen. [8] Die Dendriten sind mit dendritischen Dornen bedeckt, von denen jede synaptische Eingabe von einer parallelen Faser erhält. Purkinje-Zellen erhalten mehr synaptische Inputs als jeder andere Zelltyp im Gehirn - Schätzungen der Anzahl der Stacheln einer einzelnen menschlichen Purkinje-Zelle reichen bis zu 200.000. [8] Die großen, sphärischen Zellkörper von Purkinje-Zellen werden in eine Zelle gepackt schmale Schicht (eine Zelle dick) der Kleinhirnrinde, Purkinje-Schicht . Nachdem sie Kollateralen ausgesandt hatten, die in der Nähe der Kortikalis liegen, wandern ihre Axone in die tiefen Kleinhirnkerne, wo sie in der Größenordnung von 1.000 Kontakten mit verschiedenen Arten von Kernzellen bilden, die alle in einem kleinen Bereich liegen. Purkinje-Zellen verwenden GABA als Neurotransmitter und üben daher hemmende Wirkungen auf ihre Ziele aus. [8]
Purkinje-Zellen bilden das Herz des Kleinhirnkreislaufs, und aufgrund ihrer großen Größe und ihrer ausgeprägten Aktivitätsmuster ist es relativ einfach, ihre Reaktionsmuster im Verhalten zu untersuchen Tiere, die extrazelluläre Aufnahmetechniken verwenden. Purkinje-Zellen emittieren normalerweise Aktionspotentiale mit hoher Geschwindigkeit, auch wenn keine synaptischen Signale vorhanden sind. Bei wachen Tieren, die sich benehmen, sind Durchschnittsraten um 40 Hz typisch. Die Spitzenzüge zeigen eine Mischung aus sogenannten einfachen und komplexen Spitzen. Eine einfache Spitze ist ein einzelnes Aktionspotential, gefolgt von einer Refraktärzeit von etwa 10 ms; Eine komplexe Spitze ist eine stereotype Sequenz von Aktionspotentialen mit sehr kurzen Intervallen zwischen den Spitzen und abnehmenden Amplituden. [18] Physiologische Studien haben gezeigt, dass komplexe Spitzen (die bei Basislinienraten um 1 Hz auftreten und niemals bei Raten, die viel höher als 10 Hz sind) sind zuverlässig mit der Aktivierung der Kletterfaser verbunden, während einfache Spitzen durch eine Kombination aus Basisaktivität und paralleler Fasereingabe erzeugt werden. Auf komplexe Spikes folgt häufig eine Pause von mehreren hundert Millisekunden, in der die einfache Spike-Aktivität unterdrückt wird. [19]
Ein spezifisches, erkennbares Merkmal von Purkinje-Neuronen ist die Expression von Calbindin. [20] Calbindin-Färbung von Rattenhirn nach einseitigem chronischem Ischiasnerv Verletzungen deuten darauf hin, dass Purkinje-Neuronen möglicherweise im erwachsenen Gehirn neu erzeugt werden, wodurch die Organisation neuer Kleinhirnlappen eingeleitet wird. [21]

Granulazellen [ edit ]

Cerebellar-Granulazellen im Gegensatz zu Purkinje-Zellen gehören zu den kleinsten Neuronen im Gehirn. Sie sind auch die mit Abstand zahlreichsten Neuronen im Gehirn: Beim Menschen liegen Schätzungen der Gesamtzahl im Durchschnitt bei etwa 50 Milliarden, was bedeutet, dass etwa drei Viertel der Neuronen des Gehirns Kleinhirn-Granulazellen sind. [8] Ihre Zellkörper sind gepackt eine dicke Schicht am unteren Rand der Kleinhirnrinde. Eine Granulazelle emittiert nur vier bis fünf Dendriten, von denen jede in einer Erweiterung endet, die als dendritische Klaue bezeichnet wird . [8] Diese Vergrößerungen sind Orte exzitatorischen Eintrags von Moosfasern und inhibitorischen Eintrags von Golgi-Zellen. [19659057] Die dünnen, unmyelinisierten Axone von Granulazellen steigen senkrecht zur oberen (molekularen) Schicht der Kortikalis auf, wo sie sich in zwei Hälften teilen, wobei sich jeder Ast horizontal erstreckt und eine parallele Faser bildet. Die Aufteilung des vertikalen Zweigs in zwei horizontale Zweige führt zu einer unverwechselbaren "T" -Form. Eine humane Parallelfaser verläuft durchschnittlich 3 mm in jede Richtung von der Spaltung entfernt und hat eine Gesamtlänge von etwa 6 mm (etwa 1/10 der Gesamtbreite der kortikalen Schicht). [8] Parallele Fasern durchlaufen die dendritischen Bäume der Purkinje-Zellen und berühren jeweils eines von 3–5, die sie passieren, wodurch insgesamt 80–100 synaptische Verbindungen mit dendritischen Purkinje-Zellstacheln hergestellt werden. [8] Granulazellen verwenden Glutamat als Neurotransmitter und daher üben exzitatorische Wirkungen auf ihre Ziele aus. [8]
Granulazellen erhalten ihren gesamten Input aus moosigen Fasern, aber zahlenmäßig mehr als 200 zu 1 (beim Menschen). Somit ist die Information im Aktivitätszustand der Granulazellpopulation derselbe wie die Information in den Moosfasern, jedoch auf weitaus expansivere Weise umcodiert. Da die Granulazellen so klein und dicht gepackt sind, ist es schwierig, ihre Spitzenaktivität beim Verhalten von Tieren zu erfassen, so dass nur wenige Daten als Grundlage für das Theoretisieren zur Verfügung stehen. Das populärste Konzept ihrer Funktion wurde 1969 von David Marr vorgeschlagen, der vorschlug, Kombinationen von moosigen Fasereingaben zu kodieren. Die Idee ist, dass, wenn jede Granulazelle Input von nur 4–5 Moosfasern erhält, eine Granulazelle nicht antworten würde, wenn nur einer ihrer Inputs aktiv wäre, sondern dass sie reagieren würde, wenn mehr als eine aktiv wäre. Dieses kombinatorische Kodierungsschema würde dem Kleinhirn möglicherweise erlauben, feinere Unterscheidungen zwischen Eingabemustern zu treffen, als es die Moosfasern allein erlauben würden. [22]
Moosfasern [ edit ]
Mossy-Fasern dringen in das Granulat ein Schicht aus ihren Ursprungspunkten, viele aus den Pontinkernen, andere aus dem Rückenmark, den Vestibularkernen usw. Im menschlichen Kleinhirn wurde die Gesamtzahl der Moosfasern auf etwa 200 Millionen geschätzt. [8] Diese Fasern bilden eine Erregung Synapsen mit den Granula-Zellen und den Zellen der tiefen Kleinhirnkerne. Innerhalb der körnigen Schicht erzeugt eine Moosfaser eine Reihe von Vergrößerungen, die Rosetten genannt werden. Die Kontakte zwischen Moosfasern und Granulazellendendriten finden innerhalb von Glomeruli statt. Jedes Glomerulus hat in der Mitte eine Moosfaser-Rosette und bis zu 20 dendritische Klauen mit Granulazellen, die es berühren. Terminals aus Golgi-Zellen infiltrieren die Struktur und bilden hemmende Synapsen auf die Granulazellendendriten. Die gesamte Assemblage ist von einer Hülle aus Gliazellen umgeben. [8] Jede Moosfaser schickt Seitenzweige an mehrere Kleinhirnfolien und erzeugt insgesamt 20–30 Rosetten; So kommt eine einzelne Moosfaser mit geschätzten 400–600 Granula-Zellen in Kontakt. [8]
Kletternde Fasern [ edit
Purkinje-Zellen erhalten auch Eingaben vom unteren Olivenkern auf der kontralateralen Seite des Hirnstamms über Kletterfasern. Obwohl die Olive inferior in der Medulla oblongata liegt und Input vom Rückenmark, Hirnstamm und der Großhirnrinde erhält, geht ihr Output vollständig in das Kleinhirn über. Eine Kletterfaser gibt Kollateralen an die tiefen Kleinhirnkerne ab, bevor sie in die Kleinhirnrinde eintritt, wo sie sich in etwa zehn terminale Äste aufspaltet, von denen jeder Eingang zu einer einzelnen Purkinje-Zelle gibt. [8] In auffälligem Gegensatz zu den über 100.000 Eingängen von parallele Fasern, jede Purkinje-Zelle erhält Eingang von genau einer Kletterfaser; Aber diese einzelne Faser "klettert" die Dendriten der Purkinje-Zelle, wickelt sich um sie herum und macht dabei insgesamt bis zu 300 Synapsen. [8] Der Nettoeintrag ist so stark, dass ein einzelnes Aktionspotential einer Kletterfaser geeignet ist Herstellung einer ausgedehnten komplexen Spitze in der Purkinje-Zelle: Ein Stoß von mehreren Spitzen in einer Reihe mit abnehmender Amplitude, gefolgt von einer Pause, während der die Aktivität unterdrückt wird. Die Kletterfasersynapsen bedecken den Zellkörper und die proximalen Dendriten; In dieser Zone gibt es keine parallelen Glasfasereingaben. [8]
Kletternde Fasern feuern mit geringen Geschwindigkeiten, aber ein einzelnes Faserpotenzial für die Kletterwirkung löst in einer Purkinje-Zielzelle (einer komplexen Spitze) einen Stoß mehrerer Aktionspotentiale aus. Der Kontrast zwischen parallelen Faser- und Kletterfasereingaben in Purkinje-Zellen (über 100.000 eines Typs im Vergleich zu genau einem anderen Typ) ist möglicherweise das aufregendste Merkmal der Kleinhirnanatomie und hat viele Theorien motiviert. Tatsächlich ist die Funktion des Kletterns von Fasern das umstrittenste Thema in Bezug auf das Kleinhirn. Es gibt zwei Denkrichtungen, eine nach Marr und Albus, die davon ausgehen, dass das Steigern der Glasfasereingaben hauptsächlich als Lehrsignal dient, und die andere hält es für die Funktion, die Ausgabe von Kleinhirn direkt zu formen. Beide Ansichten wurden in zahlreichen Publikationen umfassend verteidigt. In den Worten eines Reviews: "Beim Versuch, die verschiedenen Hypothesen über die Funktion der Kletterfasern zu synthetisieren, hat man das Gefühl, eine Zeichnung von Escher zu betrachten. Jeder Standpunkt scheint eine bestimmte Sammlung von Befunden zu erklären, aber Wenn man versucht, die verschiedenen Ansichten zusammenzustellen, erscheint kein kohärentes Bild davon, was die Kletterfasern tun. Für die Mehrheit der Forscher signalisieren die Kletterfasern Fehler in der Motorleistung, entweder in der üblichen Art der Entladungsfrequenzmodulation oder als Eine einzige Ankündigung eines "unerwarteten Ereignisses". Für andere Ermittler liegt die Nachricht im Grad der Ensemble-Synchronität und Rhythmizität unter einer Population von Kletterfasern. "[19]
Tiefe Kerne [ edit

Die tiefen Kerne des Cerebellums sind Cluster von grauer Materie, die w liegen In der weißen Substanz im Herzen des Kleinhirns. Sie sind mit Ausnahme der nahe gelegenen vestibulären Kerne die einzigen Quellen für die Ausgabe aus dem Kleinhirn. Diese Kerne erhalten Projektionsvorsprünge aus Moosfasern und Kletterfasern sowie einen inhibitorischen Input aus den Purkinje-Zellen der Kleinhirnrinde. Die vier Kerne (Dentat, Globose, Emboliform und Fastigial) kommunizieren jeweils mit verschiedenen Teilen des Gehirns und der Kleinhirnrinde. (Die Globose und die Emboliformkerne werden auch als in dem dazwischen liegenden Kern kombiniert bezeichnet). Das Fastigial und die dazwischen liegenden Kerne gehören zum Spinocerebellum. Der Nucleus dentatus, der bei Säugetieren viel größer ist als die anderen, ist als dünne, gewundene Schicht aus grauer Materie ausgebildet und kommuniziert ausschließlich mit den lateralen Teilen der Kleinhirnrinde. Der flocculonoduläre Lappen ist der einzige Teil der Kleinhirnrinde, der nicht in die tiefen Kerne projiziert, sondern in die vestibulären Kerne. [8]
Die Mehrzahl der Neuronen in den tiefen Kernen besitzt große Zellkörper und kugelförmige dendritische Bäume mit einem Radius von etwa 400 μm und verwenden Glutamat als Neurotransmitter. Diese Zellen projizieren auf eine Vielzahl von Zielen außerhalb des Kleinhirns. Mit ihnen vermischt ist eine kleinere Anzahl kleiner Zellen, die GABA als Neurotransmitter verwenden und ausschließlich auf den unteren Olivenkern, die Quelle der Kletterfasern, projizieren. Somit liefert die nukleo-oliväre Projektion eine hemmende Rückkopplung, um die exzitatorische Projektion von Kletterfasern an die Kerne anzupassen. Es gibt Hinweise darauf, dass jede kleine Gruppe von Kernzellen auf dieselbe Gruppe von Olivenzellen projiziert, die Kletterfasern an sie senden; In beiden Richtungen gibt es eine starke und übereinstimmende Topographie. [8]
Wenn ein Purkinje-Zellaxon in einen der tiefen Kerne eindringt, verzweigt es sich, um sowohl mit großen als auch mit kleinen Kernzellen in Kontakt zu treten, aber die Gesamtzahl der kontaktierten Zellen beträgt nur etwa 35 ( bei Katzen). Umgekehrt erhält eine einzelne tiefe Kernzelle Eingang von etwa 860 Purkinje-Zellen (wiederum bei Katzen). [8]
Abteilungen [ edit

Unter dem Gesichtspunkt der groben Anatomie scheint die Kleinhirnrinde eine homogene Gewebebahn zu sein, und unter dem Gesichtspunkt der Mikroanatomie scheinen alle Teile dieser Schicht die gleiche innere Struktur zu haben . Es gibt jedoch eine Reihe von Aspekten, in denen die Struktur des Kleinhirns unterteilt ist. Es gibt große Abteile, die allgemein als Zonen bekannt sind. Diese lassen sich in kleinere Kompartimente unterteilen, die als Mikrozonen bezeichnet werden. . [23]
Die ersten Anzeichen für eine Kompartimentstruktur kamen aus Untersuchungen der rezeptiven Felder von Zellen in verschiedenen Teilen der Kleinhirnrinde. [23] Jede Körperteilkarte zu bestimmten Punkten im Kleinhirn, aber es gibt zahlreiche Wiederholungen der Basiskarte, wodurch eine Anordnung gebildet wird, die als "frakturierte Somatotopie" bezeichnet wird. [24] Ein deutlicherer Hinweis auf die Kompartimentierung wird durch Immunfärbung des Kleinhirns für bestimmte Proteinarten erhalten. Die bekanntesten dieser Marker werden "Zebrine" genannt, da durch die Färbung ein komplexes Muster entsteht, das an die Streifen eines Zebras erinnert. Die Streifen, die durch Zebrine und andere Kompartimentierungsmarker erzeugt werden, sind senkrecht zu den Kleinhirnfalten ausgerichtet, dh sie sind in mediolateraler Richtung schmal, in Längsrichtung jedoch viel länger. Unterschiedliche Marker erzeugen unterschiedliche Sätze von Streifen, deren Breiten und Längen je nach Standort variieren, aber sie haben alle die gleiche allgemeine Form. [23]
Oscarsson schlug in den späten 70er Jahren vor, diese kortikalen Zonen in kleinere Einheiten zu unterteilen, die als Mikrozonen bezeichnet werden. [25] Eine Mikrozone ist definiert als eine Gruppe von Purkinje-Zellen, die alle das gleiche somatotopische Rezeptionsfeld haben. Es wurde gefunden, dass Mikrozonen in der Größenordnung von 1000 Purkinje-Zellen angeordnet sind, die in einem langen, schmalen Streifen angeordnet sind, der senkrecht zu den kortikalen Falten ausgerichtet ist. [23] So werden, wie das nebenstehende Diagramm zeigt, die Purkinje-Zelldendriten in derselben Richtung abgeflacht wie die Mikrozonen strecken sich, während parallele Fasern sie im rechten Winkel kreuzen. [8]
Nicht nur aufnahmefähige Felder definieren die Mikrozonenstruktur: Der Kletterfasereingang aus dem unteren Olivenkern ist ebenfalls wichtig. Die Zweige einer Kletterfaser (normalerweise etwa 10) aktivieren in der Regel Purkinje-Zellen, die zu derselben Mikrozone gehören. Außerdem neigen olivare Neuronen, die Kletterfasern in dieselbe Mikrozone senden, durch Gap Junctions, die ihre Aktivität synchronisieren, und sind daher in der Lage, Purkinje-Zellen innerhalb einer Mikrozone korrelierte komplexe Spike-Aktivität auf einer Millisekunden-Zeitskala zu zeigen. [23] Auch Purkinje Zellen, die zu einer Mikrozone gehören, senden alle ihre Axone zu denselben kleinen Cluster von Ausgangszellen innerhalb der tiefen Kleinhirnkerne. [23] Schließlich sind die Axone von Korbzellen in Längsrichtung viel länger als in mediolateraler Richtung, was dazu führt, dass sie sich befinden weitgehend auf eine einzige Mikrozone beschränkt. [23] Die Folge all dieser Strukturen ist, dass zelluläre Wechselwirkungen innerhalb einer Mikrozone viel stärker sind als Wechselwirkungen zwischen verschiedenen Mikrozonen. [23]
Im Jahr 2005 fassten Richard Apps und Martin Garwicz den Beweis zusammen, dass Mikrozonen selbst einen Teil bilden von einer größeren Entität nennen sie einen multizonalen Mikrokomplex. Ein solcher Mikrokomplex umfasst mehrere räumlich voneinander getrennte kortikale Mikrozonen, die alle auf dieselbe Gruppe von tiefen Kleinhirnneuronen projizieren, sowie eine Gruppe gekoppelter olivarer Neuronen, die auf alle eingeschlossenen Mikrozonen sowie den tiefen Kernbereich projizieren. [23]
Funktion [ edit ]
Die stärksten Hinweise auf die Funktion des Kleinhirns ergeben sich aus der Untersuchung der Schadensfolgen. Tiere und Menschen mit Kleinhirnfunktionsstörungen zeigen vor allem Probleme mit der motorischen Kontrolle auf derselben Körperseite wie der beschädigte Teil des Kleinhirns. Sie sind weiterhin in der Lage, motorische Aktivität zu erzeugen, verlieren jedoch an Präzision und erzeugen unberechenbare, unkoordinierte oder falsch getimte Bewegungen. Ein Standardtest der Kleinhirnfunktion ist, mit der Fingerspitze ein Ziel auf Armlänge zu erreichen: Eine gesunde Person bewegt die Fingerspitze in einer schnellen geraden Flugbahn, wohingegen eine Person mit Kleinhirnschaden langsam und unberechenbar mit vielen in der Mitte erreicht -Kurskorrekturen. Defizite bei nichtmotorischen Funktionen sind schwieriger zu erkennen. Die allgemeine Schlussfolgerung vor Jahrzehnten ist daher, dass die grundlegende Funktion des Kleinhirns darin besteht, die detaillierte Form einer Bewegung zu kalibrieren, keine Bewegungen einzuleiten oder zu entscheiden, welche Bewegungen ausgeführt werden sollen. [10]
Vor den 1990er Jahren die Funktion des Kleinhirns Es wurde fast allgemein angenommen, dass es rein motorisch ist, aber neuere Erkenntnisse haben diese Ansicht in Frage gestellt. Studien zur funktionellen Bildgebung haben die Aktivierung von Kleinhirn in Bezug auf Sprache, Aufmerksamkeit und mentale Bilder gezeigt. Korrelationsstudien haben Wechselwirkungen zwischen dem Kleinhirn und den nichtmotorischen Bereichen der Großhirnrinde gezeigt; und eine Vielzahl von nichtmotorischen Symptomen wurde bei Menschen mit einer Schädigung erkannt, die auf das Kleinhirn beschränkt zu sein scheint. [26][27] Insbesondere das zerebelläre kognitive affektive Syndrom oder das Schmahmann-Syndrom [28] wurde bei Erwachsenen beschrieben [29] und Kinder. [30] Schätzungen, die auf einer funktionellen Kartierung des Kleinhirns mittels funktioneller MRI basieren, legen nahe, dass mehr als die Hälfte der Kleinhirnrinde mit Assoziationszonen der Großhirnrinde verbunden ist. [31]
Kenji Doya hat die Auffassung vertreten, dass die Kleinhirnfunktion am besten verstanden wird in Bezug auf das Verhalten, das es beeinflusst, aber die neuronalen Berechnungen, die es ausführt; Das Kleinhirn besteht aus einer Vielzahl von mehr oder weniger unabhängigen Modulen, die alle dieselbe geometrisch reguläre innere Struktur haben. Daher wird davon ausgegangen, dass alle diese Berechnungen durchführen. Wenn sich die Eingangs- und Ausgangsanschlüsse eines Moduls (wie viele) mit Motorbereichen befinden, wird das Modul in das Motorverhalten einbezogen. Wenn es sich bei den Verbindungen jedoch um Bereiche handelt, die an der nichtmotorischen Wahrnehmung beteiligt sind, zeigt das Modul andere Arten von Verhaltenskorrelaten an. So wurde das Kleinhirn in die Regulierung vieler unterschiedlicher funktioneller Merkmale wie Zuneigung, Emotion und Verhalten einbezogen. [32][33] Das Kleinhirn, so schlägt Doya vor, wird am besten als vorhersagende Handlungsauswahl verstanden, die auf "internen Modellen" der Umgebung oder einem Gerät basiert for supervised learning, in contrast to the basal ganglia, which perform reinforcement learning, and the cerebral cortex, which performs unsupervised learning.[27][34]
Principles[edit]
The comparative simplicity and regularity of the cerebellar anatomy led to an early hope that it might imply a similar simplicity of computational function, as expressed in one of the first books on cerebellar electrophysiology, The Cerebellum as a Neuronal Machine by John C. Eccles, Masao Ito, and János Szentágothai.[35] Although a full understanding of cerebellar function has remained elusive, at least four principles have been identified as important: (1) fe edforward processing, (2) divergence and convergence, (3) modularity, and (4) plasticity.
- Feedforward processing: The cerebellum differs from most other parts of the brain (especially the cerebral cortex) in that the signal processing is almost entirely feedforward—that is, signals move unidirectionally through the system from input to output, with very little recurrent internal transmission. The small amount of recurrence that does exist consists of mutual inhibition; there are no mutually excitatory circuits. This feedforward mode of operation means that the cerebellum, in contrast to the cerebral cortex, cannot generate self-sustaining patterns of neural activity. Signals enter the circuit, are processed by each stage in sequential order, and then leave. As Eccles, Ito, and Szentágothai wrote, "This elimination in the design of all possibility of reverberatory chains of neuronal excitation is undoubtedly a great advantage in the performance of the cerebellum as a computer, because what the rest of the nervous system requires from the cerebellum is presumably not some output expressing the operation of complex reverberatory circuits in the cerebellum but rather a quick and clear response to the input of any particular set of information."[36]
- Divergence and convergence: In the human cerebellum, information from 200 million mossy fiber inputs is expanded to 40 billion granule cells, whose parallel fiber outputs then converge onto 15 million Purkinje cells.[8] Because of the way that they are lined up longitudinally, the 1000 or so Purkinje cells belonging to a microzone may receive input from as many as 100 million parallel fibers, and focus their own output down to a group of less than 50 deep nuclear cells.[23] Thus, the cerebellar network receives a modest number of inputs, processes them very extensively through its rigorously structured internal network, and sends out the results via a very limited number of output cells.
- Modularity: The cerebellar system is functionally divided into more or less independent modules, which probably number in the hundreds to thousands. All modules have a similar internal structure, but different inputs and outputs. A module (a multizonal microcompartment in the terminology of Apps and Garwicz) consists of a small cluster of neurons in the inferior olivary nucleus, a set of long narrow strips of Purkinje cells in the cerebellar cortex (microzones), and a small cluster of neurons in one of the deep cerebellar nuclei. Different modules share input from mossy fibers and parallel fibers, but in other respects they appear to function independently—the output of one module does not appear to significantly influence the activity of other modules.[23]
- Plasticity: The synapses between parallel fibers and Purkinje cells, and the synapses between mossy fibers and deep nuclear cells, are both susceptible to modification of their strength. In a single cerebellar module, input from as many as a billion parallel fibers converges onto a group of less than 50 deep nuclear cells, and the influence of each parallel fiber on those nuclear cells is adjustable. This arrangement gives tremendous flexibility for fine-tuning the relationship between the cerebellar inputs and outputs.[37]
Learning[edit]
There is considerable evidence that the cerebellum plays an essential role in some types of motor learning. The tasks where the cerebellum most clearly comes into play are those in which it is necessary to make fine adjustments to the way an action is performed. There has, however, been much dispute about whether learning takes place within the cerebellum itself, or whether it merely serves to provide signals that promote learning in other brain structures.[37] Most theories that assign learning to the circuitry of the cerebellum are derived from the ideas of David Marr[22] and James Albus,[5] who postulated that climbing fibers provide a teaching signal that induces synaptic modification in parallel fiber–Purkinje cell synapses.[38] Marr assumed that climbing fiber input would cause synchronously activated parallel fiber inputs to be strengthened. Most subsequent cerebellar-learning models, however, have followed Albus in assuming that climbing fiber activity would be an error signal, and would cause synchronously activated parallel fiber inputs to be weakened. Some of these later models, such as the Adaptive Filter model of Fujita[39] made attempts to understand cerebellar function in terms of optimal control theory.
The idea that climbing fiber activity functions as an error signal has been examined in many experimental studies, with some supporting it but others casting doubt.[19] In a pioneering study by Gilbert and Thach from 1977, Purkinje cells from monkeys learning a reaching task showed increased complex spike activity—which is known to reliably indicate activity of the cell's climbing fiber input—during periods when performance was poor.[40] Several studies of motor learning in cats observed complex spike activity when there was a mismatch between an intended movement and the movement that was actually executed. Studies of the vestibulo–ocular reflex (which stabilizes the visual image on the retina when the head turns) found that climbing fiber activity indicated "retinal slip", although not in a very straightforward way.[19]
One of the most extensively studied cerebellar learning tasks is the eyeblink conditioning paradigm, in which a neutral conditioned stimulus (CS) such as a tone or a light is repeatedly paired with an unconditioned stimulus (US), such as an air puff, that elicits a blink response. After such repeated presentations of the CS and US, the CS will eventually elicit a blink before the US, a conditioned response or CR. Experiments showed that lesions localized either to a specific part of the interposed nucleus (one of the deep cerebellar nuclei) or to a few specific points in the cerebellar cortex would abolish learning of a conditionally timed blink response. If cerebellar outputs are pharmacologically inactivated while leaving the inputs and intracellular circuits intact, learning takes place even while the animal fails to show any response, whereas, if intracerebellar circuits are disrupted, no learning takes place—these facts taken together make a strong case that the learning, indeed, occurs inside the cerebellum.[41]
Theories and computational models[edit]

The large base of knowledge about the anatomical structure and behavioral functions of the cerebellum have made it a fertile ground for theorizing—there are perhaps more theories of the function of the cerebellum than of any other part of the brain. The most basic distinction among them is between "learning theories" and "performance theories"—that is, theories that make use of synaptic plasticity within the cerebellum to account for its role in learning, versus theories that account for aspects of ongoing behavior on the basis of cerebellar signal processing. Several theories of both types have been formulated as mathematical models and simulated using computers.[38]
Perhaps the earliest "performance" theory was the "delay line" hypothesis of Valentino Braitenberg. The original theory put forth by Braitenberg and Roger Atwood in 1958 proposed that slow propagation of signals along parallel fibers imposes predictable delays that allow the cerebellum to detect time relationships within a certain window.[42] Experimental data did not support the original form of the theory, but Braitenberg continued to argue for modified versions.[43] The hypothesis that the cerebellum functions essentially as a timing system has also been advocated by Richard Ivry.[44] Another influential "performance" theory is the Tensor network theory of Pellionisz and Llinás, which provided an advanced mathematical formulation of the idea that the fundamental computation performed by the cerebellum is to transform sensory into motor coordinates.[45]
Theories in the "learning" category almost all derive from publications by Marr and Albus. Marr's 1969 paper proposed that the cerebellum is a device for learning to associate elemental movements encoded by climbing fibers with mossy fiber inputs that encode the sensory context.[22] Albus proposed in 1971 that a cerebellar Purkinje cell functions as a perceptron, a neurally inspired abstract learning device.[5] The most basic difference between the Marr and Albus theories is that Marr assumed that climbing fiber activity would cause parallel fiber synapses to be strengthened, whereas Albus proposed that they would be weakened. Albus also formulated his version as a software algorithm he called a CMAC (Cerebellar Model Articulation Controller), which has been tested in a number of applications.[46]
Blood supply[edit]
The cerebellum is provided with blood from three paired major arteries: the superior cerebellar artery (SCA), the anterior inferior cerebellar artery (AICA), and the posterior inferior cerebellar artery (PICA). The SCA supplies the upper region of the cerebellum. It divides at the upper surface and branches into the pia mater where the branches anastomose with those of the anterior and posterior inferior cerebellar arteries. The AICA supplies the front part of the undersurface of the cerebellum. The PICA arrives at the undersurface, where it divides into a medial branch and a lateral branch. The medial branch continues backward to the cerebellar notch between the two hemispheres of the cerebellum; while the lateral branch supplies the under surface of the cerebellum, as far as its lateral border, where it anastomoses with the AICA and the SCA.
Clinical significance[edit]

Illustration from 1912 of the altered walking gait of a woman with cerebellar disease

The lower trace shows an attempt by a patient with cerebellar disease to reproduce the upper trace.
Damage to the cerebellum often causes motor-related symptoms, the details of which depend on the part of the cerebellum involved and how it is damaged. Damage to the flocculonodular lobe may show up as a loss of equilibrium and in particular an altered, irregular walking gait, with a wide stance caused by difficulty in balancing.[10] Damage to the lateral zone typically causes problems in skilled voluntary and planned movements which can cause errors in the force, direction, speed and amplitude of movements. Other manifestations include hypotonia (decreased muscle tone), dysarthria (problems with speech articulation), dysmetria (problems judging distances or ranges of movement), dysdiadochokinesia (inability to perform rapid alternating movements such as walking), impaired check reflex or rebound phenomenon, and intention tremor (involuntary movement caused by alternating contractions of opposing muscle groups).[47][48] Damage to the midline portion may disrupt whole-body movements, whereas damage localized more laterally is more likely to disrupt fine movements of the hands or limbs. Damage to the upper part of the cerebellum tends to cause gait impairments and other problems with leg coordination; damage to the lower part is more likely to cause uncoordinated or poorly aimed movements of the arms and hands, as well as difficulties in speed.[10] This complex of motor symptoms is called ataxia.
To identify cerebellar problems, neurological examination includes assessment of gait (a broad-based gait being indicative of ataxia), finger-pointing tests and assessment of posture.[3] If cerebellar dysfunction is indicated, a magnetic resonance imaging scan can be used to obtain a detailed picture of any structural alterations that may exist.[49]
The list of medical problems that can produce cerebellar damage is long, including stroke, hemorrhage, swelling of the brain (cerebral edema), tumors, alcoholism, physical trauma such as gunshot wounds or explosives, and chronic degenerative conditions such as olivopontocerebellar atrophy.[50][51] Some forms of migraine headache may also produce temporary dysfunction of the cerebellum, of variable severity.[52] Infection can result in cerebellar damage in such conditions as the prion diseases[53] and Miller Fisher syndrome, a variant of Guillain–Barré syndrome.
Aging[edit]
The human cerebellum changes with age. These changes may differ from those of other parts of the brain.
The cerebellum is the youngest brain region (and body part) in centenarians according to an epigenetic biomarker of tissue age known as epigenetic clock: it is about 15 years younger than expected in a centenarian.[54] Further, gene expression patterns in the human cerebellum show less age-related alteration than that in the cerebral cortex.[55]
Some studies have reported reductions in numbers of cells or volume of tissue, but the amount of data relating to this question is not very large.[56][57]
Developmental and degenerative disorders[edit]

Congenital malformation, hereditary disorders, and acquired conditions can affect cerebellar structure and, consequently, cerebellar function. Unless the causative condition is reversible, the only possible treatment is to help people live with their problems.[58] Visualization of the fetal cerebellum by ultrasound scan at 18 to 20 weeks of pregnancy can be used to screen for fetal neural tube defects with a sensitivity rate of up to 99%.[59]
In normal development, endogenous sonic hedgehog signaling stimulates rapid proliferation of cerebellar granule neuron progenitors (CGNPs) in the external granule layer (EGL). Cerebellar development occurs during late embryogenesis and the early postnatal period, with CGNP proliferation in the EGL peaking during early development (postnatal day 7 in the mouse).[60] As CGNPs terminally differentiate into cerebellum granule cells (also called cerebellar granule neurons, CGNs), they migrate to the internal granule layer (IGL), forming the mature cerebellum (by post-natal day 20 in the mouse).[60] Mutations that abnormally activate Sonic hedgehog signaling predispose to cancer of the cerebellum (medulloblastoma) in humans with Gorlin Syndrome and in genetically engineered mouse models.[61][62]
Congenital malformation or underdevelopment (hypoplasia) of the cerebellar vermis is a characteristic of both Dandy–Walker syndrome and Joubert syndrome.[63][64] In very rare cases, the entire cerebellum may be absent.[65] The inherited neurological disorders Machado–Joseph disease, ataxia telangiectasia, and Friedreich's ataxia cause progressive neurodegeneration linked to cerebellar loss.[50][58] Congenital brain malformations outside the cerebellum can, in turn, cause herniation of cerebellar tissue, as seen in some forms of Arnold–Chiari malformation.[66]
Other conditions that are closely linked to cerebellar degeneration include the idiopathic progressive neurological disorders multiple system atrophy and Ramsay Hunt syndrome type I,[67][68] and the autoimmune disorder paraneoplastic cerebellar degeneration, in which tumors elsewhere in the body elicit an autoimmune response that causes neuronal loss in the cerebellum.[69] Cerebellar atrophy can result from an acute deficiency of vitamin B1 (thiamine) as seen in beriberi and in Wernicke–Korsakoff syndrome,[70] or from vitamin E deficiency.[58]
Cerebellar atrophy has been observed in many other neurological disorders including Huntington's disease, multiple sclerosis,[53]essential tremor, progressive myoclonus epilepsy, and Niemann–Pick disease. Cerebellar atrophy can also occur as a result of exposure to toxins including heavy metals or pharmaceutical or recreational drugs.[58]
Pain[edit]
There is a general consensus that the cerebellum is involved in pain processing.[71][72] The cerebellum receives pain input from both descending cortico-cerebellar pathways and ascending spino-cerebellar pathways, through the pontine nuclei and inferior olives. Some of this information is transferred to the motor system inducing a conscious motor avoidance of pain, graded according to pain intensity.
These direct pain inputs, as well as indirect inputs, are thought to induce long-term pain avoidance behavior that results in chronic posture changes and consequently, in functional and anatomical remodeling of vestibular and proprioceptive nuclei. As a result, chronic neuropathic pain can induce macroscopic anatomical remodeling of the hindbrain, including the cerebellum.[73] The magnitude of this remodeling and the induction of neuron progenitor markers suggest the contribution of adult neurogenesis to these changes.
Comparative anatomy and evolution[edit]

The circuits in the cerebellum are similar across all classes of vertebrates, including fish, reptiles, birds, and mammals.[74] There is also an analogous brain structure in cephalopods with well-developed brains, such as octopuses.[75] This has been taken as evidence that the cerebellum performs functions important to all animal species with a brain.
There is considerable variation in the size and shape of the cerebellum in different vertebrate species. In amphibians, it is little developed, and in lampreys, and hagfish, the cerebellum is barely distinguishable from the brain-stem. Although the spinocerebellum is present in these groups, the primary structures are small, paired-nuclei corresponding to the vestibulocerebellum.[76] The cerebellum is a bit larger in reptiles, considerably larger in birds, and larger yet in mammals. The large paired and convoluted lobes found in humans are typical of mammals, but the cerebellum is, in general, a single median lobe in other groups, and is either smooth or only slightly grooved. In mammals, the neocerebellum is the major part of the cerebellum by mass, but, in other vertebrates, it is typically the spinocerebellum.[76]
The cerebellum of cartilaginous and bony fishes is extraordinarily large and complex. In at least one important respect, it differs in internal structure from the mammalian cerebellum: The fish cerebellum does not contain discrete deep cerebellar nuclei. Instead, the primary targets of Purkinje cells are a distinct type of cell distributed across the cerebellar cortex, a type not seen in mammals. In mormyrid fish (a family of weakly electrosensitive freshwater fish), the cerebellum is considerably larger than the rest of the brain put together. The largest part of it is a special structure called the valvulawhich has an unusually regular architecture and receives much of its input from the electrosensory system.[77]
The hallmark of the mammalian cerebellum is an expansion of the lateral lobes, whose main interactions are with the neocortex. As monkeys evolved into great apes, the expansion of the lateral lobes continued, in tandem with the expansion of the frontal lobes of the neocortex. In ancestral hominids, and in Homo sapiens until the middle Pleistocene period, the cerebellum continued to expand, but the frontal lobes expanded more rapidly. The most recent period of human evolution, however, may actually have been associated with an increase in the relative size of the cerebellum, as the neocortex reduced its size somewhat while the cerebellum expanded.[78] The size of the human cerebellum, compared to the rest of the brain, has been increasing in size while the cerebrum decreased in size [79] With both the development and implementation of motor tasks, visual-spatial skills and learning taking place in the cerebellum, the growth of the cerebellum is thought to have some form of correlation to greater human cognitive abilities.[80] The lateral hemispheres of the cerebellum are now 2.7 times greater in both humans and apes than they are in monkeys.[79] These changes in the cerebellum size cannot be explained by greater muscle mass. They show that either the development of the cerebellum is tightly linked to that of the rest of the brain or that neural activities taking place in the cerebellum were important during Hominidae evolution. Due to the cerebellum's role in cognitive functions, the increase in its size may have played a role in cognitive expansion.[79]
Cerebellum-like structures[edit]
Most vertebrate species have a cerebellum and one or more cerebellum-like structures, brain areas that resemble the cerebellum in terms of cytoarchitecture and neurochemistry.[74] The only cerebellum-like structure found in mammals is the dorsal cochlear nucleus (DCN), one of the two primary sensory nuclei that receive input directly from the auditory nerve. The DCN is a layered structure, with the bottom layer containing granule cells similar to those of the cerebellum, giving rise to parallel fibers that rise to the superficial layer and travel across it horizontally. The superficial layer contains a set of GABAergic neurons called cartwheel cells that resemble Purkinje cells anatomically and chemically—they receive parallel fiber input, but do not have any inputs that resemble climbing fibers. The output neurons of the DCN are pyramidal cells. They are glutamatergic, but also resemble Purkinje cells in some respects—they have spiny, flattened superficial dendritic trees that receive parallel fiber input, but they also have basal dendrites that receive input from auditory nerve fibers, which travel across the DCN in a direction at right angles to the parallel fibers. The DCN is most highly developed in rodents and other small animals, and is considerably reduced in primates. Its function is not well understood; the most popular speculations relate it to spatial hearing in one way or another.[81]
Most species of fish and amphibians possess a lateral line system that senses pressure waves in water. One of the brain areas that receives primary input from the lateral line organ, the medial octavolateral nucleus, has a cerebellum-like structure, with granule cells and parallel fibers. In electrosensitive fish, the input from the electrosensory system goes to the dorsal octavolateral nucleus, which also has a cerebellum-like structure. In ray-finned fishes (by far the largest group), the optic tectum has a layer—the marginal layer—that is cerebellum-like.[74]
All of these cerebellum-like structures appear to be primarily sensory-related rather than motor-related. All of them have granule cells that give rise to parallel fibers that connect to Purkinje-like neurons with modifiable synapses, but none have climbing fibers comparable to those of the cerebellum—instead they receive direct input from peripheral sensory organs. None has a demonstrated function, but the most influential speculation is that they serve to transform sensory inputs in some sophisticated way, perhaps to compensate for changes in body posture.[74] In fact, James M. Bower and others have argued, partly on the basis of these structures and partly on the basis of cerebellar studies, that the cerebellum itself is fundamentally a sensory structure, and that it contributes to motor control by moving the body in a way that controls the resulting sensory signals.[82] Despite Bower's viewpoint, there is also strong evidence that the cerebellum directly influences motor output in mammals.[83][84]
History[edit]

Descriptions[edit]
Even the earliest anatomists were able to recognize the cerebellum by its distinctive appearance. Aristotle and Herophilus (quoted in Galen) called it the παρεγκεφαλίς (paregkephalis), as opposed to the ἐγκέφαλος (egkephalos) or brain proper. Galen's extensive description is the earliest that survives. He speculated that the cerebellum was the source of motor nerves.[85]
Further significant developments did not come until the Renaissance. Vesalius discussed the cerebellum briefly, and the anatomy was described more thoroughly by Thomas Willis in 1664. More anatomical work was done during the 18th century, but it was not until early in the 19th century that the first insights into the function of the cerebellum were obtained. Luigi Rolando in 1809 established the key finding that damage to the cerebellum results in motor disturbances. Jean Pierre Flourens in the first half of the 19th century carried out detailed experimental work, which revealed that animals with cerebellar damage can still move, but with a loss of coordination (strange movements, awkward gait, and muscular weakness), and that recovery after the lesion can be nearly complete unless the lesion is very extensive.[86] By the beginning of the 20th century, it was widely accepted that the primary function of the cerebellum relates to motor control; the first half of the 20th century produced several detailed descriptions of the clinical symptoms associated with cerebellar disease in humans.[3]
Etymology[edit]
The name cerebellum is a diminutive of cerebrum (brain);[87] it can be translated literally as little brain. The Latin name is a direct translation of the Ancient Greek παρεγκεφαλίς (paregkephalis), which was used in the works of Aristotle, the first known writer to describe the structure.[88] No other name is used in the English-language literature, but historically a variety of Greek or Latin-derived names have been used, including cerebrum parvum,[89]encephalion,[90]encranion,[89]cerebrum posterius,[91] and parencephalis.[89]
References[edit]
- ^ Hodos, William (2009), "Evolution of Cerebellum", Encyclopedia of NeuroscienceSpringer, pp. 1240–1243, doi:10.1007/978-3-540-29678-2_3124, ISBN 978-3-540-23735-8
- ^ Wolf U, Rapoport MJ, Schweizer TA (2009). "Evaluating the affective component of the cerebellar cognitive affective syndrome". Journal of Neuropsychiatry and Clinical Neurosciences. 21 (3): 245–53. doi:10.1176/jnp.2009.21.3.245. PMID 19776302.
- ^ a b c d Fine EJ, Ionita CC, Lohr L (December 2002). "The history of the development of the cerebellar examination". Seminars in Neurology. 22 (4): 375–84. doi:10.1055/s-2002-36759. PMID 12539058.
- ^ a b Purves, Dale (2011). Dale Purves, ed. Neuroscience (5th ed.). Sunderland, Mass.: Sinauer. pp. 417–423. ISBN 978-0-87893-695-3.
- ^ a b c Albus JS (1971). "A theory of cerebellar function". Math. Biosciences. 10 (1–2): 25–61. CiteSeerX 10.1.1.14.7524. doi:10.1016/0025-5564(71)90051-4.
- ^ Purves, Dale Purves (2007). Neuroscience (4th ed.). New York: W. H. Freeman. pp. 197–200. ISBN 978-0-87893-697-7.
- ^ Susan Standring; Neil R. Borley; et al., eds. (2008). "Chapter 20". Gray's anatomy : the anatomical basis of clinical practice (40th ed.). London: Churchill Livingstone. p. 297. ISBN 978-0-8089-2371-8.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y Llinas RR, Walton KD, Lang EJ (2004). "Ch. 7 Cerebellum". In Shepherd GM. The Synaptic Organization of the Brain. New York: Oxford University Press. ISBN 978-0-19-515955-4.
- ^ Herculano-Houzel S (2010). "Coordinated scaling of cortical and cerebellar numbers of neurons". Frontiers in Neuroanatomy. 4: 12. doi:10.3389/fnana.2010.00012. PMC 2839851. PMID 20300467.
- ^ a b c d e f g h i j Ghez C, Fahn S (1985). "The cerebellum". In Kandel ER, Schwartz JH. Principles of Neural Science, 2nd edition. New York: Elsevier. pp. 502–522.CS1 maint: Uses editors parameter (link)
- ^ Kingsley RE (2000). Concise Text of Neuroscience (2nd ed.). Lippincott Williams & Wilkins. ISBN 978-0-683-30460-2.
- ^ Petersen SE, Fox PT, Posner MI, Mintun M, Raichle ME (1989). "Positron emission tomographic studies of the processing of single words". Journal of Cognitive Neuroscience. 1 (2): 153–70. doi:10.1162/jocn.1989.1.2.153. PMID 23968463.
- ^ Timmann D, Daum I (2007). "Cerebellar contributions to cognitive functions: a progress report after two decades of research". Cerebellum. 6 (3): 159–62. doi:10.1080/14734220701496448. PMID 17786810.
- ^ Strick PL, Dum RP, Fiez JA (2009). "Cerebellum and nonmotor function". Annual Review of Neuroscience. 32: 413–34. doi:10.1146/annurev.neuro.31.060407.125606. PMID 19555291.
- ^ Buckner RL (October 2013). "The cerebellum and cognitive function: 25 years of insight from anatomy and neuroimaging". Neuron. 80 (3): 807–15. doi:10.1016/j.neuron.2013.10.044. PMID 24183029.
- ^ Schweighofer N, Doya K, Kuroda S (March 2004). "Cerebellar aminergic neuromodulation: towards a functional understanding". Brain Research. Brain Research Reviews. 44 (2–3): 103–16. doi:10.1016/j.brainresrev.2003.10.004. PMID 15003388.
- ^ Felizola SJ, Nakamura Y, Ono Y, Kitamura K, Kikuchi K, Onodera Y, Ise K, Takase K, Sugawara A, Hattangady N, Rainey WE, Satoh F, Sasano H (April 2014). "PCP4: a regulator of aldosterone synthesis in human adrenocortical tissues". Journal of Molecular Endocrinology. 52 (2): 159–67. doi:10.1530/JME-13-0248. PMC 4103644. PMID 24403568.
- ^ Eccles JC, Llinás R, Sasaki K (January 1966). "The excitatory synaptic action of climbing fibres on the Purkinje cells of the cerebellum". Journal of Physiology. 182 (2): 268–96. doi:10.1113/jphysiol.1966.sp007824. PMC 1357472. PMID 5944665.
- ^ a b c d Simpson JI, Wylie DR, De Zeeuw CI (1996). "On climbing fiber signals and their consequence(s)". Behav. Brain Sci. 19 (3): 384–398. doi:10.1017/S0140525X00081486.
- ^ Whitney ER, Kemper TL, Rosene DL, Bauman ML, Blatt GJ (February 2008). "Calbindin-D28k is a more reliable marker of human Purkinje cells than standard Nissl stains: a stereological experiment". Journal of Neuroscience Methods. 168 (1): 42–7. doi:10.1016/j.jneumeth.2007.09.009. PMID 17961663.
- ^ Rusanescu G, Mao J (February 2017). "Peripheral nerve injury induces adult brain neurogenesis and remodelling". Journal of Cellular and Molecular Medicine. 21 (2): 299–314. doi:10.1111/jcmm.12965. PMC 5264155. PMID 27665307.
- ^ a b c Marr D (June 1969). "A theory of cerebellar cortex". Journal of Physiology. 202 (2): 437–70. doi:10.1113/jphysiol.1969.sp008820. PMC 1351491. PMID 5784296.
- ^ a b c d e f g h i j k Apps R, Garwicz M (April 2005). "Anatomical and physiological foundations of cerebellar information processing". Nature Reviews. Neuroscience. 6 (4): 297–311. doi:10.1038/nrn1646. PMID 15803161.
- ^ Manni E, Petrosini L (March 2004). "A century of cerebellar somatotopy: a debated representation". Nature Reviews. Neuroscience. 5 (3): 241–9. doi:10.1038/nrn1347. PMID 14976523.
- ^ Oscarsson O (1979). "Functional units of the cerebellum-sagittal zones and microzones". Trends Neurosci. 2: 143–145. doi:10.1016/0166-2236(79)90057-2.
- ^ Rapp B (2001). The Handbook of Cognitive Neuropsychology: What Deficits Reveal about the Human Mind. Psychologie Presse. p. 481. ISBN 978-1-84169-044-5.
- ^ a b Doya K (December 2000). "Complementary roles of basal ganglia and cerebellum in learning and motor control". Current Opinion in Neurobiology. 10 (6): 732–9. doi:10.1016/S0959-4388(00)00153-7. PMID 11240282.
- ^ Manto M, Mariën P (2015). "Schmahmann's syndrome - identification of the third cornerstone of clinical ataxiology". Cerebellum & Ataxias. 2: 2. doi:10.1186/s40673-015-0023-1. PMC 4552302. PMID 26331045.
- ^ Schmahmann JD, Sherman JC (April 1998). "The cerebellar cognitive affective syndrome". Brain. 121 ( Pt 4) (4): 561–79. doi:10.1093/brain/121.4.561. PMID 9577385.
- ^ Levisohn L, Cronin-Golomb A, Schmahmann JD (May 2000). "Neuropsychological consequences of cerebellar tumour resection in children: cerebellar cognitive affective syndrome in a paediatric population". Brain. 123 ( Pt 5) (5): 1041–50. doi:10.1093/brain/123.5.1041. PMID 10775548.
- ^ Buckner RL, Krienen FM, Castellanos A, Diaz JC, Yeo BT (November 2011). "The organization of the human cerebellum estimated by intrinsic functional connectivity". Journal of Neurophysiology. 106 (5): 2322–45. doi:10.1152/jn.00339.2011. PMC 3214121. PMID 21795627.
- ^ Hernáez-Goñi P, Tirapu-Ustárroz J, Iglesias-Fernández L, Luna-Lario P (November 2010). "Participación del cerebelo en la regulación del afecto, la emoción y la conducta" [The role of the cerebellum in the regulation of affection, emotion and behavior]. Revista de Neurologia (in Spanish). 51 (10): 597–609. PMID 21069639. Archived from the original on 2014-08-19.
- ^ Turner BM, Paradiso S, Marvel CL, Pierson R, Boles Ponto LL, Hichwa RD, Robinson RG (March 2007). "The cerebellum and emotional experience". Neuropsychologia. 45 (6): 1331–41. doi:10.1016/j.neuropsychologia.2006.09.023. PMC 1868674. PMID 17123557.
- ^ Doya K (October 1999). "What are the computations of the cerebellum, the basal ganglia and the cerebral cortex?". Neural Networks. 12 (7–8): 961–974. doi:10.1016/S0893-6080(99)00046-5. PMID 12662639.
- ^ Eccles JC, Ito M, Szentágothai J (1967). The Cerebellum as a Neuronal Machine. Springer-Verlag.
- ^ The Cerebellum as a Neuronal Machinep. 311
- ^ a b Boyden ES, Katoh A, Raymond JL (2004). "Cerebellum-dependent learning: the role of multiple plasticity mechanisms". Annual Review of Neuroscience. 27: 581–609. doi:10.1146/annurev.neuro.27.070203.144238. PMID 15217344.
- ^ a b Houk JC, Buckingham JT, Barto AG (1996). "Models of the cerebellum and motor learning" (PDF). Behav. Brain Sci. 19 (3): 368–383. CiteSeerX 10.1.1.118.2997. doi:10.1017/S0140525X00081474. Archived from the original (PDF) on 2017-08-09.
- ^ Fujita M (1982). "Adaptive filter model of the cerebellum". Biological Cybernetics. 45 (3): 195–206. doi:10.1007/BF00336192. PMID 7171642.
- ^ Gilbert PF, Thach WT (June 1977). "Purkinje cell activity during motor learning". Brain Research. 128 (2): 309–28. doi:10.1016/0006-8993(77)90997-0. PMID 194656.
- ^ Christian KM, Thompson RF (2003). "Neural substrates of eyeblink conditioning: acquisition and retention". Learning & Memory. 10 (6): 427–55. doi:10.1101/lm.59603. PMID 14657256.
- ^ Braitenberg V, Atwood RP (February 1958). "Morphological observations on the cerebellar cortex". Journal of Comparative Neurology. 109 (1): 1–33. doi:10.1002/cne.901090102. PMID 13563670.
- ^ Braitenberg V, Heck D, Sultan F (June 1997). "The detection and generation of sequences as a key to cerebellar function: experiments and theory". Behavioral and Brain Sciences. 20 (2): 229–45, discussion 245–77. doi:10.1017/s0140525x9700143x. PMID 10096998.
- ^ Ivry RB, Spencer RM, Zelaznik HN, Diedrichsen J (December 2002). "The cerebellum and event timing". Annals of the New York Academy of Sciences. 978 (1): 302–17. Bibcode:2002NYASA.978..302I. doi:10.1111/j.1749-6632.2002.tb07576.x. PMID 12582062.
- ^ Pellionisz A, Llinás R (1982). "Space-time representation in the brain. The cerebellum as a predictive space-time metric tensor". Neuroscience. 7 (12): 2949–70. doi:10.1016/0306-4522(82)90224-X. PMID 7162624.
- ^ Horváth G (2003). "CMAC: Reconsidering an old neural network" (PDF). Intelligent Control Systems and Signal Processing. Retrieved 2009-12-24.
- ^ Schmitz TJ (2007). "Examination of Coordination". In O'Sullivan SB, Schmitz TJ. Physical Rehabilitation. Philadelphia: F. A. Davis. pp. 193–225.CS1 maint: Uses editors parameter (link)
- ^ Mariën P, Manto M (2016). The linguistic cerebellum. London, UK: Academic Press. pp. 337–351. ISBN 978-0-12-801608-4.
- ^ Gilman S (March 1998). "Imaging the brain. Second of two parts". New England Journal of Medicine. 338 (13): 889–96. doi:10.1056/NEJM199803263381307. PMID 9516225.
- ^ a b "NINDS Ataxias and Cerebellar or Spinocerebellar Degeneration Information Page". Nationales Gesundheitsinstitut. 16 April 2014. Archived from the original on 9 February 2015. Retrieved 2 February 2015.
- ^ Yuhas D (January 15, 2016). "Veterans of Iraq, Afghanistan Show Brain Changes Related to Explosion Exposure". Scientific American. Archived from the original on January 20, 2016. Retrieved January 21, 2016.
- ^ Vincent M, Hadjikhani N (June 2007). "The cerebellum and migraine". Headache. 47 (6): 820–33. doi:10.1111/j.1526-4610.2006.00715.x. PMC 3761082. PMID 17578530.
- ^ a b "NINDS Cerebellar Degeneration Information Page". Nationales Gesundheitsinstitut. 28 February 2014. Archived from the original on 18 February 2015. Retrieved 2 February 2015.
- ^ Horvath S, Mah V, Lu AT, Woo JS, Choi OW, Jasinska AJ, Riancho JA, Tung S, Coles NS, Braun J, Vinters HV, Coles LS (May 2015). "The cerebellum ages slowly according to the epigenetic clock" (PDF). Aging. 7 (5): 294–306. doi:10.18632/aging.100742. PMC 4468311. PMID 26000617. Archived (PDF) from the original on 2015-05-25.
- ^ Fraser HB, Khaitovich P, Plotkin JB, Pääbo S, Eisen MB (September 2005). "Aging and gene expression in the primate brain". PLoS Biology. 3 (9): e274. doi:10.1371/journal.pbio.0030274. PMC 1181540. PMID 16048372.
- ^ Andersen BB, Gundersen HJ, Pakkenberg B (November 2003). "Aging of the human cerebellum: a stereological study". Journal of Comparative Neurology. 466 (3): 356–65. doi:10.1002/cne.10884. PMID 14556293.
- ^ Raz N, Gunning-Dixon F, Head D, Williamson A, Acker JD (2001). "Age and sex differences in the cerebellum and the ventral pons: a prospective MR study of healthy adults" (PDF). American Journal of Neuroradiology. 22 (6): 1161–7. PMID 11415913. Archived (PDF) from the original on 2008-12-17.
- ^ a b c d Albert, Richard K.; Porter, Robert S., eds. (2006). The Merck Manual of Diagnosis and Therapy (18th ed.). Whitehouse Station, New Jersey: Merck Research Libraries. pp. 1886–1887.
- ^ Campbell J, Gilbert WM, Nicolaides KH, Campbell S (August 1987). "Ultrasound screening for spina bifida: cranial and cerebellar signs in a high-risk population". Obstetrics and Gynecology. 70 (2): 247–50. PMID 3299184.
- ^ a b Hatten ME, Heintz N (1995). "Mechanisms of neural patterning and specification in the developing cerebellum". Annual Review of Neuroscience. 18: 385–408. doi:10.1146/annurev.ne.18.030195.002125. PMID 7605067.
- ^ Polkinghorn WR, Tarbell NJ (May 2007). "Medulloblastoma: tumorigenesis, current clinical paradigm, and efforts to improve risk stratification". Nature Clinical Practice. Oncology. 4 (5): 295–304. doi:10.1038/ncponc0794. PMID 17464337.
- ^ Roussel MF, Hatten ME (2011). Cerebellum development and medulloblastoma. Current Topics in Developmental Biology. 94. pp. 235–82. doi:10.1016/B978-0-12-380916-2.00008-5. ISBN 9780123809162. PMC 3213765. PMID 21295689.
- ^ "NINDS Joubert Syndrome Information Page". Nationales Gesundheitsinstitut. 23 December 2013. Archived from the original on 4 January 2015. Retrieved 9 January 2015.
- ^ "NINDS Dandy-Walker Information Page". Nationales Gesundheitsinstitut. 14 February 2014. Archived from the original on 4 January 2015. Retrieved 9 January 2015.
- ^ "NINDS Cerebellar Hypoplasia Information Page". Nationales Gesundheitsinstitut. 29 September 2011. Archived from the original on 4 January 2015. Retrieved 9 January 2015.
- ^ "Chiari Malformation Fact Sheet". Nationales Gesundheitsinstitut. 10 December 2014. Archived from the original on 27 October 2011. Retrieved 9 January 2015.
- ^ "NINDS Dyssynergia Cerebellaris Myoclonica Information Page". Nationales Gesundheitsinstitut. 14 February 2011. Archived from the original on 16 February 2015. Retrieved 1 February 2015.
- ^ "NINDS Olivopontocerebellar Atrophy Information Page". Nationales Gesundheitsinstitut. 16 April 2014. Archived from the original on 27 January 2012. Retrieved 9 January 2015.
- ^ "NINDS Paraneoplastic Syndromes Information Page". Nationales Gesundheitsinstitut. 12 March 2009. Archived from the original on 4 January 2015. Retrieved 9 January 2015.
- ^ "NINDS Wernicke-Korsakoff Syndrome Information Page". Nationales Gesundheitsinstitut. 14 February 2007. Archived from the original on 4 January 2015. Retrieved 9 January 2015.
- ^ Moulton EA, Schmahmann JD, Becerra L, Borsook D (October 2010). "The cerebellum and pain: passive integrator or active participator?". Brain Research Reviews. 65 (1): 14–27. doi:10.1016/j.brainresrev.2010.05.005. PMC 2943015. PMID 20553761.
- ^ Baumann O, Borra RJ, Bower JM, Cullen KE, Habas C, Ivry RB, Leggio M, Mattingley JB, Molinari M, Moulton EA, Paulin MG, Pavlova MA, Schmahmann JD, Sokolov AA (April 2015). "Consensus paper: the role of the cerebellum in perceptual processes". Cerebellum. 14 (2): 197–220. doi:10.1007/s12311-014-0627-7. PMC 4346664. PMID 25479821.
- ^ Rusanescu G, Mao J (February 2017). "Peripheral nerve injury induces adult brain neurogenesis and remodelling". Journal of Cellular and Molecular Medicine. 21 (2): 299–314. doi:10.1111/jcmm.12965. PMC 5264155. PMID 27665307.
- ^ a b c d Bell CC, Han V, Sawtell NB (2008). "Cerebellum-like structures and their implications for cerebellar function". Annual Review of Neuroscience. 31: 1–24. doi:10.1146/annurev.neuro.30.051606.094225. PMID 18275284.
- ^ Woodhams PL (July 1977). "The ultrastructure of a cerebellar analogue in octopus". Journal of Comparative Neurology. 174 (2): 329–45. doi:10.1002/cne.901740209. PMID 864041.
- ^ a b Romer AS, Parsons TS (1977). The Vertebrate Body. Philadelphia: Holt-Saunders International. p. 531. ISBN 978-0-03-910284-5.
- ^ Shi Z, Zhang Y, Meek J, Qiao J, Han VZ (August 2008). "The neuronal organization of a unique cerebellar specialization: the valvula cerebelli of a mormyrid fish". Journal of Comparative Neurology. 509 (5): 449–73. doi:10.1002/cne.21735. PMC 5884697. PMID 18537139.
- ^ Weaver AH (March 2005). "Reciprocal evolution of the cerebellum and neocortex in fossil humans". Proceedings of the National Academy of Sciences of the United States of America. 102 (10): 3576–80. Bibcode:2005PNAS..102.3576W. doi:10.1073/pnas.0500692102. PMC 553338. PMID 15731345.
- ^ a b c Schoenemann PT (December 1, 2009). "Evolution of Brain and Language". Language Learning. 59: 162–186. doi:10.1111/j.1467-9922.2009.00539.x.
- ^ MacLeod CE, Zilles K, Schleicher A, Rilling JK, Gibson KR (April 2003). "Expansion of the neocerebellum in Hominoidea". Journal of Human Evolution. 44 (4): 401–29. doi:10.1016/S0047-2484(03)00028-9. PMID 12727461.
- ^ Roberts PD, Portfors CV (June 2008). "Design principles of sensory processing in cerebellum-like structures. Early stage processing of electrosensory and auditory objects". Biological Cybernetics. 98 (6): 491–507. doi:10.1007/s00422-008-0217-1. PMID 18491162.
- ^ Bower JM (1997). Is the cerebellum sensory for motor's sake, or motor for sensory's sake: the view from the whiskers of a rat?. Progress in Brain Research. 114. pp. 463–96. doi:10.1016/S0079-6123(08)63381-6. ISBN 978-0-444-82313-7. PMID 9193161.
- ^ Heiney SA, Kim J, Augustine GJ, Medina JF (February 2014). "Precise control of movement kinematics by optogenetic inhibition of Purkinje cell activity". Journal of Neuroscience. 34 (6): 2321–30. doi:10.1523/JNEUROSCI.4547-13.2014. PMC 3913874. PMID 24501371.
- ^ Witter L, Canto CB, Hoogland TM, de Gruijl JR, De Zeeuw CI (2013). "Strength and timing of motor responses mediated by rebound firing in the cerebellar nuclei after Purkinje cell activation". Frontiers in Neural Circuits. 7: 133. doi:10.3389/fncir.2013.00133. PMC 3748751. PMID 23970855.
- ^ Clarke E, O'Malley CD (1996). "Ch. 11: Cerebellum". The Human Brain and Spinal Cord (2nd ed.). Norman Publishing. p. 629. ISBN 978-0-930405-25-0.
- ^ Ito M (December 2002). "Historical review of the significance of the cerebellum and the role of Purkinje cells in motor learning". Annals of the New York Academy of Sciences. 978 (1): 273–88. Bibcode:2002NYASA.978..273I. doi:10.1111/j.1749-6632.2002.tb07574.x. PMID 12582060.
- ^ Lewis CT, Short C (1879). A Latin dictionary founded on Andrews' edition of Freund's Latin dictionary. Oxford: Clarendon Press.
- ^ Marshall LH, Magoun HW (1998). Discoveries in the human brain. Neuroscience prehistory, brain structure, and function. Totowa: Humana Press.
- ^ a b c Foster FD (1891). An illustrated medical dictionary. New York: D. Appleton and Company.
- ^ Kraus LA (1844). Kritisch-etymologisches medicinisches Lexikon (Dritte Auflage). Göttingen: Verlag der Deuerlich- und Dieterichschen Buchhandlung.
- ^ Schreger CH (1805). Synonymia anatomica. Synonymik der anatomischen Nomenclatur. Fürth.
External links[edit]
| Wikimedia Commons has media related to Cerebellum. |
- Cerebellum Rodolfo Llinas and Mario N. Negrello, Scholarpedia, 10(1):4606. doi:10.4249/scholarpedia.4606
- Cerebellum–Cell Centered Database
- Handbook of the Cerebellum and Cerebellar Disorders – Manto, M., Gruol, D.L., Schmahmann, J., Koibuchi, N., Rossi, F. (Eds.) – Springer – New York
- Stained brain slice images which include the "cerebellum" at the BrainMaps project
- A Man's Incomplete Brain Reveals Cerebellum's Role In Thought And Emotion
- Woman living without cerebellum
- Essentials of Cerebellum and Cerebellar Disorders. Gruol, D.L., Koibuchi, N., Manto, M., Molinari, M., Schmahmann, J.D., Shen, Y. (Eds.). Springer, New York, 2016
- Cerebellum histology images
- The Cerebellum – Journal (Springer Nature)
- Cerebellum and Ataxias – Journal (BioMed Central)

Không có nhận xét nào:
Đăng nhận xét